Em entrevista, médico patologista Jorge Sampaio, primeiro coordenador-geral do BrCAST, diz que portaria veio para preencher um vazio regulatório: “Havia uma demanda da OMS”.
Um importante passo em direção ao controle mais eficiente da resistência microbiana foi dado no Brasil quando entrou em vigor no fim de 2019 a Portaria nº 64/2018 do Ministério da Saúde. A medida padroniza a interpretação dos testes de sensibilidade no país ao tornar compulsório o uso das normas do BrCAST-EUCAST em todos os laboratórios clínicos.
O BrCAST – ou Brazilian Committee on Antimicrobial Susceptibility Testing – é um comitê formado pelas sociedades brasileiras de Patologia Clínica/Medicina Laboratorial, de Análises Clínicas, de Infectologia e de Microbiologia. O comitê determina e revisa periodicamente pontos de corte para interpretação dos testes de sensibilidade aos antimicrobianos.
Mentor e primeiro coordenador-geral do BrCAST, o médico patologista clínico Jorge Sampaio, doutor em Microbiologia e Imunologia e em Doenças Infecciosas, avalia que a portaria do Ministério da Saúde veio para preencher um vazio regulatório: “Pela primeira vez na história do Brasil temos uma recomendação oficial para a realização de testes de sensibilidade”, destaca o professor de Microbiologia Clínica da Faculdade de Ciências Farmacêuticas da Universidade de São Paulo (USP).
Por ser o BrCAST reconhecido oficialmente como um comitê nacional, o EUCAST – European Committee on Antimicrobial Susceptibility Testing – permite que todos os seus documentos sejam traduzidos e disponibilizados aos laboratórios de forma gratuita por meio do BrCAST.
Na entrevista a seguir, Jorge Sampaio, que hoje atua no BrCAST no subcomitê para microrganismos sem pontos de corte, explica por que o EUCAST é mais adequado à realidade brasileira do que o comitê americano (CLSI, Clinical and Laboratory Standards Institute), por exemplo, e lembra os desafios enfrentados durante o processo de discussão sobre que norma deveria ser regulamentada no Brasil.
“Toda mudança gera reações, seja pela inércia, seja pela incapacidade de ver que o país precisava dessa mudança”, diz ele. “Todos nós, membros do BrCAST, trabalhamos voluntariamente, pensando num Brasil melhor”.
Em breve será publicada uma segunda parte da entrevista, em que o médico patologista lista as vantagens da adequação dos laboratórios às normas.
Qual a importância de os laboratórios aderirem às normas de interpretação EUCAST/versão BrCAST?
No Brasil, havia uma grande heterogeneidade de critérios interpretativos para testes de sensibilidade aos antimicrobianos; portanto, grande parte dos dados de testes de sensibilidade com resultados apenas de categorias (S/I/R) não eram comparáveis, o que enviesava a comparação dos perfis de sensibilidade gerados por laboratórios no Brasil.
A oficialização do BrCAST no Brasil pelo Ministério da Saúde atendeu não só à demanda das sociedades científicas envolvidas na criação do BrCAST, mas também ao próprio Ministério da Saúde, pois havia uma demanda da Organização Mundial da Saúde (OMS) para que todos os países do mundo tivessem um programa nacional de combate à resistência microbiana. A padronização da interpretação dos testes de sensibilidade em todo o Brasil foi um passo fundamental para que se pudesse ter um panorama fidedigno do perfil de resistência nas diferentes regiões do Brasil e que se pudesse planejar medidas para o controle efetivo da resistência microbiana.
Por que foram definidas essas normas como as mais adequadas aos nossos laboratórios?
A maioria dos laboratórios no Brasil não tinha acesso aos documentos atualizados e os documentos do CLSI (Clinical and Laboratory Standards Institute) são em inglês, ou seja, no Brasil tínhamos documentos de referência para testes de sensibilidade apenas em inglês. O CLSI, como resposta à crescente implementação do EUCAST nos laboratórios em todo o mundo, tornou disponível para leitura, mas não para impressão ou download, o principal documento para interpretação dos testes de sensibilidade (M100). Por outro lado, o CLSI não tornou disponíveis os documentos M2, M7 e M45 que devem, obrigatoriamente, ser utilizados em conjunto com o M100.
Pela primeira vez na história do Brasil temos uma recomendação oficial para a realização de testes de sensibilidade. Havia um vazio regulatório.
Como coordenador do BrCAST, quais foram os maiores desafios que o senhor enfrentou nesse processo de adequação – desde antes da publicação da portaria até agora?
Toda mudança gera reações, seja pela inércia de manter o status quo, seja pela incapacidade de ver que o Brasil precisava dessa mudança e que havia um vazio regulatório. O maior desafio foi convencer a ANVISA e o Ministério da Saúde a iniciar o processo de discussão de qual norma deveria ser regulamentada no Brasil.
Todos nós membros do BrCAST trabalhamos voluntariamente, pensando num Brasil melhor. Talvez o maior desafio seja convencer a todos de que estamos mudando para melhor ou ter que a todo momento contradizer inverdades disseminadas por uma minoria insatisfeita, a exemplo das inverdades contidas no abaixo-assinado que chegou a ser feito contra a portaria 64.
Que passos os laboratórios precisaram seguir nessa adequação?
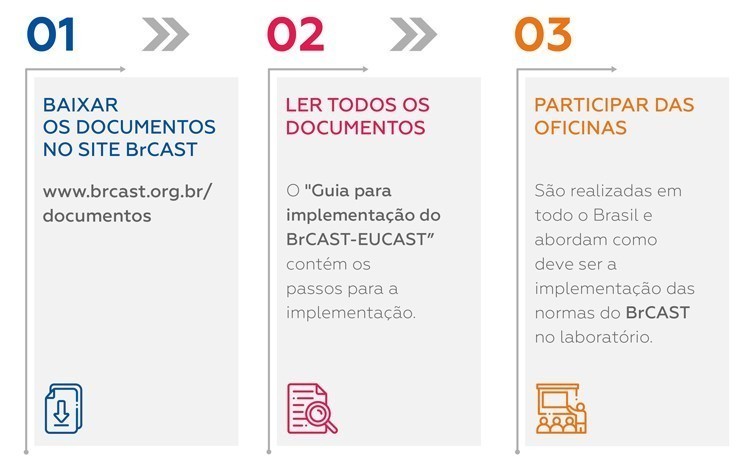
O primeiro passo é baixar, imprimir e ler todos os documentos. Há um documento disponível no site http://www.brcast.org.br, “Guia para implementação do BrCAST-EUCAST”, que descreve os passos que devem ser seguidos para a implementação. Os documentos podem ser baixados em http://brcast.org.br/documentos/.
Além disso, durante todo o ano de 2019 foram organizadas oficinas do BrCAST nas diferentes regiões do Brasil, abordando como deve ser a implementação das normas do BrCAST no laboratório. Os arquivos das aulas são disponibilizados no site e permitem àqueles que não puderam comparecer, revisar o assunto.
Mais informações sobre as oficinas em http://brcast.org.br/aulas-brcast
O Programa Cepas Controle, da Controllab, abrange todos os microrganismos listados em cada norma de referência do BrCAST para o controle de qualidade. Na sua avaliação, qual a contribuição de um serviço como esse para a adequação dos laboratórios?
A manutenção adequada de cepas de controle de qualidade demanda que o laboratório tenha um freezer a -70ºC. Este equipamento tem alto custo e um número muito pequeno de laboratórios no Brasil tem este equipamento. A proposta de fornecimento programado de cepas liofilizadas garante que o laboratório terá as cepas sempre em condições adequadas para realização dos testes de controle de qualidade e facilita em muito o trabalho do laboratório.
Para saber mais sobre o Programa CEPAS CONTROLE, que permite ao laboratório ter mais tempo para se dedicar às análises dos exames, com um processo de controle de qualidade mais prático e com uso reduzido de recursos da infraestrutura, acesse www.controllab.com
Os laboratórios têm participado ativamente dessa programação educativa?
Em todas as oficinas temos atingido o número máximo de participantes. Os microbiologistas do Brasil são, em sua maioria absoluta, profissionais dedicados e que querem o melhor para o seu trabalho e para os pacientes que atendem; portanto, tem sido fácil convencer os microbiologistas a padronizar o BrCAST na rotina, frente aos argumentos de necessidade de uma única padronização no Brasil e maior segurança para os pacientes implementando o BrCAST.
Estão previstas mais ações?

A próxima atividade será o encontro em 17 de março de 2020, que ocorrerá na Universidade de São Paulo e será gratuito, previsto para 800 participantes. Informações sobre a agenda em http://brcast.org.br/aulas-brcast/
Pretendemos ao longo de 2020 continuar ministrando cursos de capacitação para uso das normas do BrCAST nas diferentes regiões do Brasil. Alguns deles terão abordagem teórico-prática para que o treinamento seja mais efetivo. A próxima oficina será voltada para treinamento de laboratórios centrais de saúde pública e será teórico-prática.
Mais informações sobre eventos e cursos de capacitação podem ser obtidas no site e nas redes sociais do BrCAST.

